杜玲嫻 副教授 | 化學系
國立臺灣師範大學化學系副教授,2005年畢業於國立臺灣師範大學化學所,並於2014年取得紐約州立大學石溪分校的化學博士學位,接著在中央研究院基因體中心進行二年的博士後研究,於2016年至國立臺灣師範大學任職。專注於研究探討類澱粉蛋白纖維的形成,並利用天然小分子或新穎材料干擾蛋白質聚集,期有助於了解蛋白質聚集與疾病的關聯性。

【本篇報導由化學系 杜玲嫻副教授研究團隊提供】
阿茲海默病(Alzheimer’s disease,AD)的特點之一是由β-澱粉樣蛋白(Aβ)形成的細胞外老年斑塊(senile plaque),並沉積於患者大腦之中。以往的研究顯示,AD大腦中的斑塊與醣化最終產物(advanced glycation end products)位處於相同的區塊,醣化最終產物主要由一系列蛋白質與還原醣或反應性極高的二羰基化合物反應的結果,與一般經由酵素專一性修飾的過程不同。本研究證明,醣化反應可以增加Aβ的細胞毒性。
蛋白質醣化(Protein glycation)早先因與幾種糖尿病相關的疾病有關,而受到關注。此外,它還被視為蛋白質聚集的調節劑。近年,又因為許多醣化最終產物的積累與多種神經退行性疾病有關,它啟發了許多團隊探索因分子醣化影響的病理機制。在過往的研究中發現,同年齡的AD大腦比正常大腦增加了三倍的醣化最終產物,而且他們與Aβ-澱粉樣蛋白沉積的位置高度重疊,表明Aβ極可能被醣化修飾。醣化修飾過後的Aβ顯現出更高的細胞毒性。雖然不清楚為何這些醣化修飾後的Aβ沉積無法被有效地清除,但至少我們的研究可以使我們更加清楚毒性的來源。基本上,Aβ蛋白有兩個胺基酸位點可以發生醣化反應。研究團隊發現(如圖1),這兩個位置的醣化結果都會影響Aβ的聚集過程,影響了蛋白形成纖維的速度,但取而代之的是形成更具毒性的寡聚體(oligomer),推測是醣化的結果改變了這兩個胺基酸的電性,使得蛋白質的堆疊產生了一些排斥的力量。尤其是第28號位置的離胺酸,在過去,它一直被視為分子肽鏈之間鹽橋的提供者,一旦電性發生改變,就更難往聚集的方向前進,但卻形成具有細胞通透性的寡聚體,意外提高分子毒性,因此醣化有可能加劇罹患AD的機率。所以平衡血液中糖分的濃度並避免蛋白質醣化反應的發生,也是預防疾病的重要方式之一。
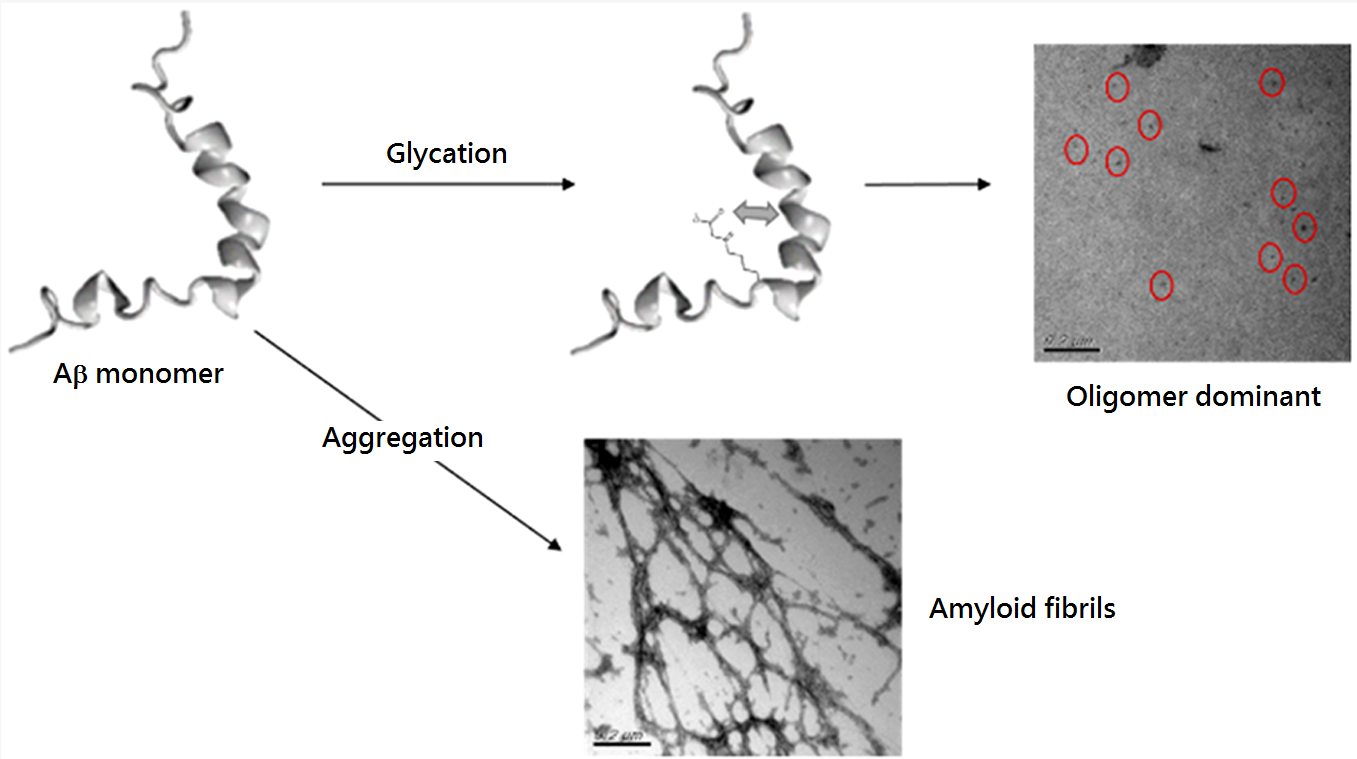
圖1:Aβ單體經醣化修飾過後影響其聚集行為
原文出處:Hu, K. W., Fan, H. F., Lin, H. C., Huang, J. W., Chen, Y. C., Shen, C. L., Shih, Y. H., & Tu, L. H. (2021). Exploring the Impact of Glyoxal Glycation on β-Amyloid Peptide (Aβ) Aggregation in Alzheimer's Disease. Journal of Physical Chemistry B, 125(21), 5559-5571. https://doi.org/10.1021/acs.jpcb.1c02797

國立臺灣師範大學化學系副教授,2005年畢業於國立臺灣師範大學化學所,並於2014年取得紐約州立大學石溪分校的化學博士學位,接著在中央研究院基因體中心進行二年的博士後研究,於2016年至國立臺灣師範大學任職。專注於研究探討類澱粉蛋白纖維的形成,並利用天然小分子或新穎材料干擾蛋白質聚集,期有助於了解蛋白質聚集與疾病的關聯性。